Assalammu‘alaikum wr. wb.
Hello guys! Apakah kalian sudah mempersiapkan diri untuk menghadapi Ujian Sekolah (US)? Sebenarnya Ujian ini sebagai pengganti Ujian Nasional (UN) yang telah ditiadakan oleh Pemerintah akibat dari Pandemi COVID-19. Dan kali ini saya akan membagikan Kisi-kisi Ujian Sekolah (US) untuk Pelajaran Kimia (IPA).
Berikut, inilah Materi Kisi-kisi US SMA untuk Pelajaran Kimia yang saya ambil dari beberapa Sumber di Internet. Dan juga Materi ini diambil dari Pelajaran Kelas 10, 11, dan sampai dengan Kelas 12.
1. Konsep Metode Ilmiah
Ilmu Kimia menjawab banyak permasalahan berlandaskan Eksperimen dan penalaran akal sehat. Eksperimen yang dilakukan harus sistematis dan logis. Oleh karena itu, diperlukan suatu metode standar dalam pelaksanaannya, maka digunakanlah metode ilmiah. Metode Ilmiah adalah metode sains yang menggunakan langkah-langkah ilmiah dan rasional untuk mengungkapkan suatu permasalahan yang muncul dalam pemikiran kita.
[Untuk selengkapnya, silahkan lihat di sini.]
2. Konfigurasi Elektron (Aturan Aufbau)
Konfigurasi Elektron adalah susunan Elektron berdasarkan Kulit atau Orbital dari suatu Atom. Jadi ada 2 (Dua) Cara menyatakan Konfigurasi Elektron. Namun Konfigurasi Elektron berdasarkan orbital atom itu, lebih berguna untuk mempelajari sifat-sifat suatu zat kimia, termasuk mengapa ada zat kimia yang berwarna-warni.
Dan berikut, inilah aturan penentuan Konfigurasi Elektron berdasarkan Orbital yang diatur dalam Aturan Aufbau :
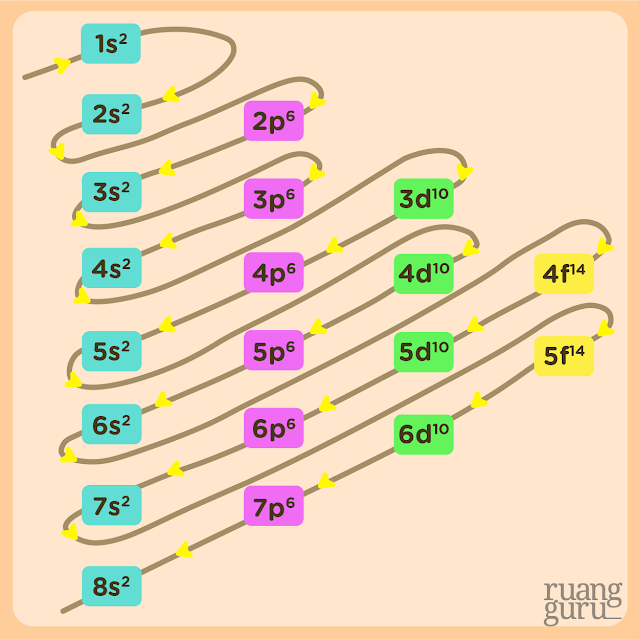 |
| Sumber : Blog Ruangguru |
3. Sistem Periodik Unsur (Golongan dan Periode)
Sistem Periodik Unsur ini memiliki 2 Subbab yaitu Golongan dan Periode/Periodik Unsur. Golongan ditempatkan pada lajur vertikal dalam sistem periodik unsur modern. Penentuan golongan berkaitan dengan sifat-sifat yang dimiliki unsur tersebut. Unsur-unsur dalam satu golongan memiliki sifat-sifat yang mirip. Beberapa golongan diberi nama khusus, yaitu :
 |
| Sumber : Blog Ruangguru |
Sedangkan jika Periode ditempatkan pada lajur horizontal dalam sistem periodik unsur kimia. Periode suatu unsur menunjukkan nomor kulit yang sudah terisi Elektron (n terbesar) berdasarkan konfigurasi elektron. Dalam sistem periodik unsur terdapat 7 periode, yaitu :
 |
| Sumber : Blog Ruangguru |
Dan inilah Gambar Tabel Periodik Unsur yang ada di bawah ini :
4. Bilangan Kuantum
Bilangan Kuantum (Dalam Fungsi Gelombang) adalah bilangan yang memiliki makna khusus dalam menjelaskan keadaan sistem kuantum. Bilangan-bilangan kuantum dapat memberikan deskripsi keadaan elektron dalam atom.
Kombinasi bilangan kuantum n, l, dan ml yang mungkin pada 4 kulit elektron pertama dapat dilihat pada tabel berikut :

Salah satu contoh atom di alam semesta ini adalah atom karbon. Atom kabon adalah penyusun dari berbagai benda yang sangat berguna. Mulai dari bensin, plastik, berlian, bahkan tubuh kita pun tersusun dari karbon! Nah, karbon (biasa dilambangkan dengan huruf C) punya 6 elektron. Bagaimana Bilangan Kuantum dari elektron terakhirnya?
 |
| Sumber : Blog Ruangguru |
5. Elektrolit dan Non-Elektrolit
Larutan Elektrolit adalah larutan yang dapat menghantarkan Listrik, sedangkan Larutan Non-Elektrolit adalah larutan yang tidak dapat menghantarkan listrik. Larutan Elektrolit dapat dibedakan menjadi elektrolit kuat dan elektrolit lemah. Elektrolit Kuat mempunyai daya hantar yang relatif tinggi walaupun konsentrasinya relatif kecil, sedangkan Elektrolit Lemah mempunya daya hantar yang relatif rendah walaupun konsentrasinya relatif besar.
6. Persamaan Reaksi (Stoikiometri)
Stoikiometri adalah dasar Perhitungan Kimia yang menyatakan Relasi Kuantitatif Rumus Kimia dan Persamaan Kimia. Dalam Stoikiometri juga terdapat 2 Subbab yaitu, Rumus Empiris dan Rumus Molekuler.
Untuk menentukan Rumus Empiris, ada beberapa langkah yang harus kalian lakukan, yaitu sebagai berikut.
- Rumus Empiris bisa ditentukan melalui rumus molekul, yaitu dengan menyederhanakan jumlah atom penyusun rumus molekul agar diperoleh bilangan bulat paling kecil.
- Rumus Empiris juga bisa ditentukan melalui perbandingan mol unsur-unsur penyusun senyawa, dengan syarat massanya diketahui.
Sedangkan untuk Rumus Molekul merupakan rumus yang jumlah atomnya kelipatan dari Rumus Empiris. Namun demikian, ada beberapa senyawa yang memiliki rumus molekul dan Empiris sama. Untuk menentukan rumus molekul, gunakan persamaan berikut.

[Untuk selengkapnya, silahkan lihat di sini (Quipper Blog).]
7. Ikatan Kimia
Ketika 2 (Dua) Atom atau ion “berpegangan” dengan sangat erat, dapat dikatan bahwa di antaranya terdapat suatu ikatan kimia. Dalam pembentukannya, yang berperan adalah Elektron Valensi, yaitu elektron yang berada pada kulit terluar. Untuk memudahkan penggambaran Elektron Valensi pada atom suatu unsur dan ikatan yang terbentuk dapat digunakan simbol Lewis (simbol titik-elektron Lewis).
Atom-atom cenderung ingin berikatan karena dengan adanya ikatan, energi potensial antara partikel positif dan partikel negatif — entah antar ion dengan muatan yang berlawanan ataupun antar inti dengan Elektron-elektron di antaranya — akan lebih rendah. Ikatan kimia dibagi menjadi 3 Jenis berdasarkan 3 Cara Kombinasi dari unsur logam dan unsur nonlogam, yakni logam dengan non logam (Ikatan Ionik), Non-logam dengan Non-logam (Ikatan Kovalen), dan logam dengan logam (Ikatan Logam).
[Untuk selengkapnya, silahkan lihat di sini.]
8. Kaidah Oktet (Kovalen Rangkap)
Ikatan ini dibentuk oleh atom-atom nonlogam yang menyumbangkan 2 Elektron tidak berpasangan untuk berikatan sehingga memenuhi Kaidah Oktet. Kovalen Rangkap ini juga dapat digambar dengan menggunakan Struktur Lewis.
9. Asam-Basa
Sebelumnya di Inzaghi's Blog juga pernah membahas Artikel tentang Asam dan Basa (Sebagian). Asam dan Basa merupakan dua Senyawa Kimia yang sangat penting dalam kehidupan sehari-hari kita. Secara umum, zat–zat yang memiliki Rasa Masam itu mengandung asam, misalnya asam sitrat pada jeruk, asam asetat pada cuka makanan, serta Asam Benzoat yang digunakan sebagai pengawet makanan.
10. Hidrolisis Garam
Sebelumnya di Inzaghi's Blog juga pernah membahas Artikel tentang Hidrolisis Garam. Ketika suatu Asam bereaksi dengan suatu Basa maka akan dihasilkan Senyawa ionik yang disebut garam. Larutan garam dapat bersifat Netral, Asam, ataupun Basa. Hal ini dikarenakan terjadinya Hidrolisis Garam, yaitu Reaksi dari suatu Kation atau suatu Anion, ataupun keduanya, dengan air menghasilkan ion H+(aq) atau OH−(aq). Tapi jika ingin melihat dari Sumber lainnya tentang Hidrolisis Garam, silahkan lihat di sini (Quipper Blog).
11. Titrasi Asam-Basa
Titrasi Asam-Basa merupakan suatu prosedur yang dilakukan saat kita ingin menentukan kemolaran atau kadar suatu asam atau basa berdasarkan reaksi netralisasi. Selain itu, dalam Titrasi Asam-Basa terdapat beberapa istilah yang harus kamu ketahui, beberapa istilah di antaranya :
- Pentiter, merupakan zat yang mentitrasi suatu asam-basa yang ingin ditentukan kemolarannya.
- Titik akhir Titrasi, merupakan titik saat indikator asam-basa mengalami perubahan warna
- Titik Ekuivalen, merupakan titik saat asam-basa tepat habis bereaksi
- Daerah perubahan pH drastis, merupakan daerah di mana saat terjadinya sedikit penambahan tetes pentiter, akan mengubah warna indikator asam-basa
12. Redoks (Reaksi Oksidasi)
Di kehidupan sehari-hari, kita banyak menemukan Fenomena-fenomena yang melibatkan reaksi kimia. Misalnya, Proses Fotosintesis pada Tumbuhan, Pengkaratan Besi, Pembakaran Kertas dan Logam, Proses Respirasi yang terjadi pada tubuh kita, dan masih banyak lagi. Itu semua tidak terlepas dari yang namanya reaksi kimia.
Reaksi Redoks merupakan jenis dari Reaksi Kimia yang menyebabkan perubahan bilangan oksidasi baik dalam suatu molekul ataupun unsur juga menyebabkan terjadinya perubahan (dapat berupa penambahan maupun pengurangan) senyawa oksigen di dalam suatu molekul.
Di dalam Reaksi Redoks, ada dua jenis reaksi yang bersamaan yaitu reaksi reduksi dan Reaksi Oksidasi. Reaksi reduksi sendiri merupakan reaksi yang menyebabkan penurunan bilangan oksidasi dari sebuah Ion, Atom, atau Molekul yang dapat disebabkan baik karena penangkapan elektron dan atau pelepasan oksigen. Spesi yang mengalami reduksi disebut juga sebagai Oksidator karena menyebabkan oksidasi pada pasangan senyawanya.
Sedangkan reaksi oksidasi adalah reaksi yang terjadi sehingga kemudian menyebabkan meningkatnya bilangan oksidasi dari suatu ion, atom karena pelepasan elektron dan atau penambahan Oksigen. Spesi yang mengalami oksidasi disebut juga sebagai reduktor karena menyebabkan reduksi pada pasangan senyawanya.
Di Inzaghi's Blog juga pernah membahas tentang Reaksi Oksidasi dan Reduksi (Redoks), baca dan lihat disini untuk selengkapnya.
13. Sifat-sifat Koligatif Larutan
Sifat Koligatif Larutan adalah sifat-sifat yang hanya bergantung pada Jumlah (Kuantitas) Partikel Zat Terlarut dalam larutan dan tidak bergantung pada jenis atau identitas partikel zat terlarut – tidak peduli dalam bentuk atom, ion, ataupun molekul. Sifat Koligatif merupakan sifat yang hanya memandang “Kuantitas”, bukan “Kualitas”.
Berikut, inilah Rumus-rumus yang berhubungan dengan Sifat Koligatif Larutan (Seperti Molaritas, Molalitas, Fraksi Mol, dan Faktor Van't Hoff) :
 |
| Dibuat oleh Aplikasi Canva |
14. Fraksi Mol
Fraksi Mol merupakan bagian dari Sifat Koligatif Larutan. Fraksi Mol juga sering disebut Fraksi Jumlah dan selalu identik dengan Fraksi Angka, yang digambarkan sebagai jumlah molekul suatu konstituen dibangi dengan jumlah total semua molekul. Konsep ini hanya merupakan salah satu cara menunjukkan adanya komposisi campuran dengan satuan tak berdimensi. Fraksi mol kadang-kadang dilambangkan dengan huruf Yunani daripada abjad Romawi.
Rumus-rumus dari Fraksi Mol sudah tertera diatas yaitu di bagian Sifat Koligatif Larutan.
15. Sel Volta (Elektrokimia)
Sel Volta (Sel Galvani) adalah sel elektrokimia di mana energi kimia dari reaksi redoks spontan diubah menjadi energi listrik. Prinsip kerja sel volta dalam menghasilkan arus listrik adalah aliran transfer elektron dari reaksi oksidasi di anode ke reaksi reduksi di katode melalui rangkaian luar.
Sebelumnya di Inzaghi's Blog juga pernah membahas tentang Sel Volta / Sel Galvani, baca dan lihat disini untuk selengkapnya.
16. Korosi
Apakah kamu pernah mendengar istilah karat atau perkaratan pada besi? Nah, perkaratan yang terjadi pada unsur logam seperti besi disebut juga korosi. Apa itu Korosi?
Korosi adalah perubahan logam secara fisika maupun kimia akibat hilangnya fungsi mekanis logam tersebut. Logam seperti besi bisa mengalami korosi jika bersentuhan dengan senyawa asam, air, dan mengalami perubahan suhu dalam jangka waktu yang cukup lama dan secara terus menerus.
Faktor penyebab Korosi / yang mempercepat Korosi adalah Air dan kelembaban Udara, Elektrolit, Permukaan logam yang tidak rata, dan Terbentuknya sel Elektrokimia.
Proses terjadinya Korosi merupakan proses elektrokimia. Elektrokimia adalah proses terjadinya reaksi redoks (reduksi oksidasi) secara spontan. Contohnya, korosi pada besi akan membentuk oksida besi (Fe2O3.xH2O). Besi akan teroksidasi oleh oksigen dari udara dan akan membentuk Korosi. Persamaan reaksi yang berlangsung adalah sebagai berikut.

[Untuk selengkapnya, silahkan lihat di sini (Blog Quipper) atau juga di sini (Blog Ruangguru).]
17. Senyawa Hidrokarbon
Senyawa Hidrokarbon adalah senyawa yang tersusun dari atom unsur karbon (C) dan hidrogen (H). Plastik seperti LDPE dan HDPE (Polietilena) dan PP (Polipropilena) terbuat dari Etena dan Propena yang merupakan hasil olahan gas alam. Senyawa etena dan propena termasuk ke dalam golongan Senyawa Hidrokarbon.
Dan biasanya Materi tentang Senyawa Hidrokarbon ini juga hampir berhubungan dengan Senyawa Organik.
18. Termokimia
Termokimia adalah ilmu tentang perubahan kalor (panas) suatu zat yang melibatkan proses Kimia dan Fisika. Termokimia yang merupakan bagian dari Termodinamika membahas tentang perubahan energi yang menyertai suatu reaksi kimia yang dimanifestasikan sebagai kalor reaksi. Partikel-partikel penyusun zat selalu bergerak konstan, sehingga zat memiliki energi kinetik. Energi kinetik rata-rata suatu objek berbanding lurus dengan Temperatur Absolut-nya (0 K).
Termokimia melibatkan suatu reaksi kimia, tentu saja kalau ada reaksi kimia berarti ada “reaktan” dan “produk/hasil”. Contohnya bisa lihat pada reaksi yang terjadi antara gas Metana (CH4) dan molekul Oksigen (O2), kemudian akan menghasilkan produk berupa gas karbon dioksida (CO2) dan air (H2O).
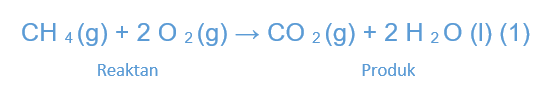
Pada reaksi tersebut, bisa kita lihat bahwa bahan bakar bergabung dengan oksigen untuk menghasilkan air dan karbon dioksida. Reaksi itu disebut dengan reaksi pembakaran. Kemudian, ketika bahan bakar (pada reaksi di atas adalah metana) diharapkan dapat melepas panas, maka disebut dengan reaksi eksoterm. Sebaliknya, reaksi yang menyerap panas disebut dengan reaksi endoterm.
[Untuk selengkapnya, silahkan lihat di sini atau juga di sini.]
19. Perubahan Entalpi
Materi ini merupakan bagian dari materi Termokimia. Perubahan Entalpi berkaitan erat dengan hukum kekekalan energi bahwa energi tidak dapat diciptakan ataupun dimusnahkan tapi dapat berubah bentuk menjadi energi lain.
Entalpi adalah banyaknya energi yang dimiliki sistem (U) dan kerja (PV) sehingga bisa dituliskan H = U + PV. Sedangkan perubahan entalpi yaitu kalor reaksi dari suatu reaksi pada tekanan tetap. Supaya entalpi dapat dihitung, maka pengukurannya harus dilakukan pada suhu serta tekanan tertentu. Menurut para kimiawan, suhu 25°C dan tekanan 1 atm adalah ukuran yang tepat untuk menilai Entalpi.
Dari gambar diatas, terlihat bahwa perubahan entalpi adalah selisih dari energi akhir dan energi awal reaksi atau dapat disimpulkan dalam persamaan :
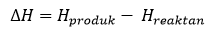
ΔH = Perubahan Entalpi Reaksi,
ΔH Produk = Entalpi hasil Reaksi,
ΔH Reaktan = Entalpi awal Reaksi.
[Untuk selengkapnya, silahkan lihat di sini (Kompas.com) atau juga di sini (Blog Ruangguru).]
Contoh lainnya dari Termokimia adalah Diagram Panah Perubahan Entalpi. Untuk lebih jelasnya, bisal lihat Soal-soalnya di sini.
20. Kesetimbangan Kimia
Kesetimbangan Kimia terjadi pada reaksi kimia yang reversibel. Reaksi reversibel adalah reaksi yang di mana produk reaksi dapat bereaksi balik membentuk reaktan. Kesetimbangan Kimia tercapai ketika laju reaksi maju sama dengan laju reaksi balik dan konsentrasi dari reaktan-reaktan dan produk-produk tidak berubah lagi.
Untuk persamaan reaksi reversibel yang berada dalam kesetimbangan pada temperatur tertentu berikut,
aA + bB ⇌ cC +dD
Konstanta Kesetimbangan, K, dapat dinyatakan sebagai rasio dari perkalian konsentrasi reaktan-reaktan dibagi perkalian konsentrasi produk-produk, di mana konsentrasi dari masing-masing substansi dipangkatkan Koefisien Stoikiometri dalam persamaan reaksi setara.

[Untuk selengkapnya, silahkan lihat di sini (Studiobelajar.com) atau juga di sini (Blog Ruangguru).]
21. Perhitungan Kimia (Konsep Mol) [BONUS]
Konsep Mol menyatakan hubungan persamaan antara jumlah mol, jumlah partikel, massa, molaritas, dan volume. Melalui konsep mol, kalian dapat mengetahui nilai yang sama antar satuan, misalnya jumlah partikel dan molaritas, atau bentuk nilai lainnya. Satu mol didefinisikan sebagai jumlah zat yang mengandung partikel zat itu sebanyak atom yang terdapat dalam 12,000 gram atom karbon – 12. Dalam satu mol suatu zat terdapat 6,022 x 1023 Partikel. Di mana, nilai 6,022 x 1023 partikel per mol disebut sebagai tetapan Avogadro, dengan lambang L atau N. Konsep mol dalam perhitungan kimia cukup penting karena dapat menjadi jembatan yang menghubungkan satu persamaan ke persamaan yang lain.
Satuan mol sama seperti satuan lain, misalnya saja satuan lusin. Ketika disebutkan 1 lusin, secara otomatis kalian akan paham bahwa jumlah yang dimaksud adalah 12 buah. Kondisi ini sama ketika menyebutkan 1 mol yang merujuk pada jumlah 6,022 x 1023 Partikel zat. Dalam konsep mol terdapat hubungan antara persamaan volume (V), massa (G), Molaritas (M), dan Jumlah Partikel (x). Hubungan persamaan dalam konsep mol diberikan seperti gambar di bawah.
Satu mol zat
mengandung jumlah partikel yang sama dengan jumlah partikel dalam 12 gram C –12
yaitu 6,02 × 1023 partikel zat yang dapat berupa atom, molekul,
atau ion. Jumlah partikel ini disebut sebagai bilangan Avogadro yang
dilambangkan dengan N atau L. Hubungan antara jumlah mol dan jumlah partikel
bergantung pada bilangan Avogadro L = 6,02 × 1023. Persamaan yang
menyatakan hubungan jumlah mol dan jumlah partikel diberikan seperti berikut.

Sumber : Idschool.net
22. Senyawa Organik (Turunan Alkana)
Dan Minggu kemarin, Inzaghi's Blog juga sempat mem-Posting Artikel tentang Senyawa Organik. Silahkan lihat dan dibaca kembali tentang Topik ini.
23. Benzena
Dan Minggu kemarin, Inzaghi's Blog juga sempat mem-Posting Artikel tentang Benzena. Silahkan lihat dan dibaca kembali tentang Topik ini.
24. Polimer (Makromolekul)
Dan Minggu kemarin, Inzaghi's Blog juga sempat mem-Posting Artikel tentang Polimer (Makromolekul). Silahkan lihat dan dibaca kembali tentang Topik ini.
Mohon maaf apabila ada sedikit Kesalahan dalam memberikan materi yang kurang jelas dan juga memberikan Link atau Dokumen yang terkait. Terima Kasih 😀👍 :)
Wassalammu‘alaikum wr. wb.




Post a Comment